
INDONESIA
インドネシア化粧品について
インドネシアにおける化粧品監督官庁
国家薬品食品管理局(Badan Pengawas Obat dan Makanan:BPOM)は非省庁政府機関*であり、医薬品、医薬品原料、麻薬、向精神薬、中毒性物質、伝統的医薬品、健康補助食品、化粧品、加工食品。業界に対する規制を定めている。インドネシア国内で化粧品を流通させるためには、BPOMへの化粧品通知が必要がある。
製品通知申請の基本的な流れ
製品の成分およびクレームがインドネシアの規制に適合しているかを事前にチェックします。
必要情報:
製品名、ブランド名
使用方法、化粧品カテゴリー
成分表(英語INCI、配合量、配合目的)
流通用ラベルデータ(パッケージ)
生産企業の名称および住所
輸入者/CNHの名称および住
必要書類:
GMP証明書
自由販売証明書
授権書(LOA)
製品規格書(COA)
授権における契約書(OEM生産の場合)
当局による書類審査期間:約1−3ヶ月
インドネシアは、製品を市場流通させている個人または企業が、PIFを保管することを義務づけている。インドネシアでは、Part 1 は通知前に準備し、Part 2 – 4は流通前に準備する必要がある。
*インドネシアのは、ASEANのPIFと基本的に同じであるが、Part 1の内容のみがASEANと異なる。
インドネシアPIFについて
PIF保管者:
化粧品通知ホルダー(CNH:Cosmetic Notification Holder)を担う企業。
PIF保管場所:
CNHの管轄で、データまたは書面で保管がされる。
PIFの提出:
製品の市場監査の際やCNHへのランダムなPIF保持調査 等
消費者からの有害事象報告があった場合、内容に応じてPIFの提出要求がある
PIF作成・保管方法:
PIFは、製品流通後少なくとも3年間*、書面または電子データで保存
言語:インドネシア語または英語
製品情報に変更・更新がある場合、PIFに追加をする必要がある
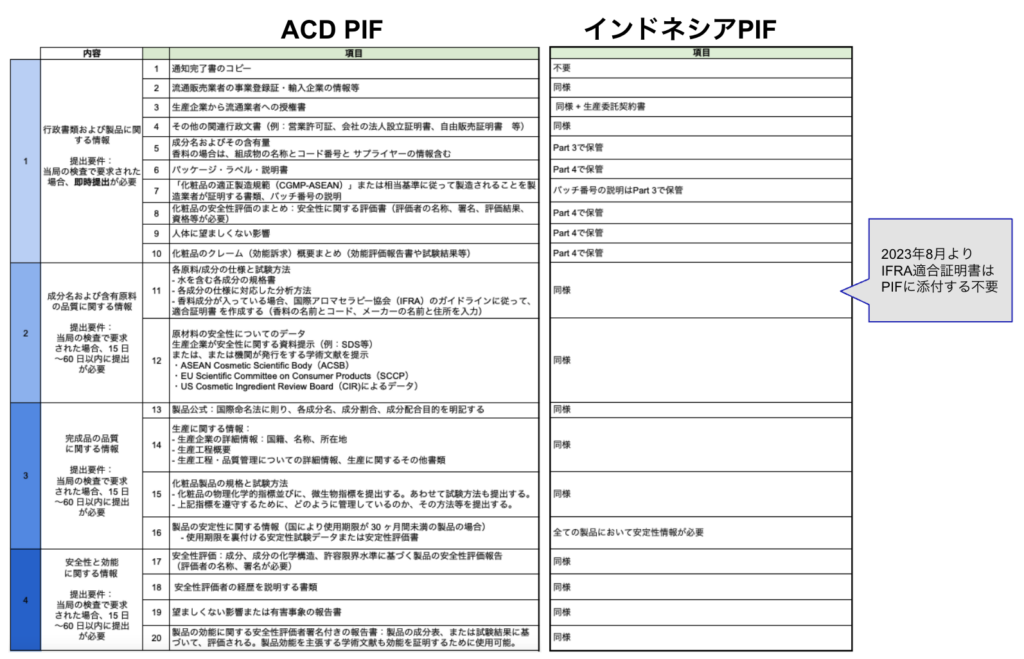
PIFの要求資料
お問い合わせ
お気軽にお問い合わせください。3営業日以内にご返答させて頂きます。
<本件に関するお問い合わせ>
株式会社WWIPコンサルティングジャパン
TEL : 03-6206-1723
Email: official@wwip.co.jp





